Chlordioxid v dezinfekci vody: Proč je lepší než chlor?
Chlordioxid (správněji oxid chloričitý) byl jako biocidní a dezinfekční látka schválen relativně nedávno, jeho používání se ale rychle rozšířilo, zejména v souvislosti s výskytem bakterií rodu Legionella. Pojďme se na tuto látku podívat trochu podrobněji.
Malé historické a chemické okénko
Používání chloru a jeho sloučenin má ve vodárenství dlouholetou tradici a sahá až do roku 1773, kdy je doloženo použití kyseliny chlorovodíkové v katedrále ve francouzském městě Dijon.
Chlordioxid neboli oxid chloričitý (ClO2) je sloučenina chloru, která byla objevena v roce 1811 britským chemikem Davym, který ho připravil reakcí chlorečnanu draselného (KClO3) a kyseliny chlorovodíkové (HCl). Za běžných podmínek se s sním setkáme ve formě oranžového plynu, při teplotách okolo −59 °C začne sloučenina krystalizovat do podoby oranžových krystalků. Chemici si možná také povšimnou toho, že jiný oxid či sloučenina halogenu (mezi halogeny patří kromě chloru též fluor, jód, brom a astat), kde by se právě halogen vyskytoval v sudém mocenství už neexistuje.
Protože se stejně jako v případě chloru jedná o explozivní plyn, není možné ho skladovat anebo přepravovat v čistém nezředěném stavu. Nejbezpečnější je proto připravovat ho přímo v místě úpravy vody.
První komerčně použitelný proces na přípravu tohoto plynu vyvinula firma Mathieson Alkali Works v roce 1930 a jeho základem byl chlorečnan sodný (NaClO3). O devět let později byl jako základ průmyslové výroby poprvé vyzkoušen chloritan sodný (NaClO2), který chlorečnan rychle vytlačil a stal se základní surovinou pro přípravu oxidu chloričitého. Tento proces je založen na okyselení zmíněného chloritanu sodného pomocí kyseliny, přičemž v praxi se nejčastěji používá HCl (kyselina chlorovodíková). Alternativou k procesu založenému na výše popsané chemické reakci je elektrolýza roztoku chloritanu sodného.
Chlordioxid je k dezinfekci vody ve větší míře používán od 50. letech minulého století a jeho potenciálu pro dezinfekce veřejných vodních zdrojů využili poprvé v Bruselu, kde v roce 1956 přešli od dezinfekce vod chlorem právě k dezinfikování chlordioxidem. Pokud bychom se ale zajímali o úplně první použití této sloučeniny, museli bychom jít ještě o pár let zpátky do roku 1944, kdy ČOV na Niagarských vodopádech použila chlordioxid k odstranění fenolu z vody.
Chlordioxid versus chlor
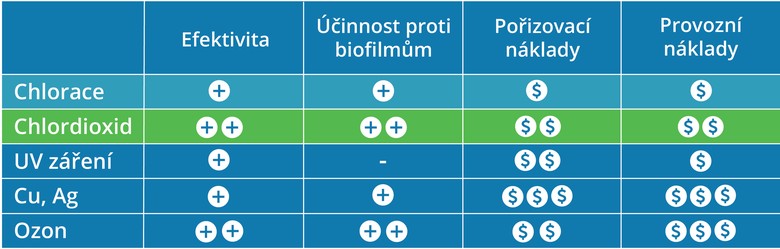
Chlordioxid lze použít k vlastní dezinfekce anebo jako předběžný oxidant před samotným chlorováním. Chlor totiž s organickými nečistotami obsaženými ve vodě tvoří tzv. trihalomethany (někdy také nazývané haloformy), které jsou podezřelé z karcinogenních účinků. Jedná se o halogenderiváty methanu (CH4), což znamená, že jeden nebo více atomů vodíku je v molekule této látky nahrazeno právě atomem některého z halogenů Nejčastěji takto vzniká trichlormethan (který je spíše známý pod triviálním názvem chloroform) a tribrommethan. Chlordioxid naopak tvoří s organickými nečistotami karbonylové sloučeniny, které jsou ve většině případů lehce rozložitelné a obecně neškodné.
Menší nebo žádná tvorba nežádoucích vedlejších produktů dezinfekce však není jediná výhoda, kterou chlordioxid ve srovnání s chlorem přináší. Zejména se vyznačuje vyšší dezinfekční kapacitou. Na rozdíl od chloru je také možné ho použít i při pH vyšším než 7 (uvádí se, že rozsah použití chlordioxidu se pohybuje v rozmezí pH mezi 4 až 10. S amonnými ionty a amino-sloučeninami chlordioxid nereaguje a tím se též snižuje pravděpodobnost vzniku nežádoucí halogenovaných organických látek, které při dezinfekci chlorem vznikají jako vedlejší produkty.
Chlordioxid se také za nízkých teplot rozpouští ve vodě lépe než chlor. Rozpustnost chlordioxidu ve vodě je za nízkých teplot oproti chloru desetinásobná. Používá se tedy hojně jako biocid v mnoha oblastech průmyslové úpravy vody, například v potravinářství ale také třeba pro úpravu vody do chladicích věží. Dále ho lze využít k oxidaci železa a manganu a též se uvádí jeho použití pro oxidaci sloučenin negativně ovlivňujících chuť a zápach vody.
Chlordioxidem proti legionelle
V posledních letech zažil chlordioxid největší boom v souvislosti s bakteriemi rodu Legionella. Je ale účinný i proti dalším bakteriím, které vykazují rezistenci vůči tradičním chemickým činidlům používaným při úpravě a zabezpečení vody, a též virům, které lze sice bez použití chemické dezinfekce též odstranit (metody založené na koagulaci, sedimentaci a filtraci), ale chemická dezinfekce je v tomto případě jednodušší a většinou zajišťuje jejich úplnou eliminaci.
Toxické účinky
Ačkoli se chlordioxid vyznačuje vynikajícími baktericidními, virucidními a algicidními vlastnostmi je méně toxický než samotný chlór. Ani chlordioxid ale není bez rizika, pro lidské zdraví mohou být škodlivé zejména vedlejší produkty jeho reakcí ve vodě, zejména chloritany a chlorečnany. Co se týče těchto toxických účinků, v nízkých dávkách chloritany vedou k hemolytické anemii a poškození červených krvinek, vyšší dávky mohou vést až k tzv. methemoglobinémii (tedy oxidaci železa obsaženého v hemoglobinu- důležitém transportním proteinu zodpovědném za přenos kyslíků v krevním řečišti), což způsobí, že takto poškozené červené krvinky už nejsou schopny uvolňovat do krve kyslík. Tato porucha je nejčastěji spojována s dusičnany (ty se po požití v trávicím traktu metabolizují na dusitany, které jsou tíž schopné hem oxidovat), a nejvíce ohrožuje děti do 6 měsíců věku. Charakteristickým projevem methemoglobinémie je zmodrání v obličeji, provázené dušností a křečemi, což může vést až k svalové obrně a smrti. Schopnost oxidovat železnatý kationt v hemoglobinu na železitý má však kromě zmíněných chloritanů celá řada dalších sloučenin, například také bromičnany vznikající reakcemi chloru s bromem. Toxické účinky chlorečnanů jsou podobné. Z výše zmíněných důvodů je nutné dbát při použití jakékoliv dezinfekce zejména správnému dávkování a svěřit tento úkon profesionálům. Ač se mohou zdravotní rizika spojená s chloritany a chlorečnany ve vodě zdát hororová, díky přísným zákonem daným limitům a správnému provedení dezinfekčních postupů se jich není nutné při použití chlordioxidu obávat.
Dávkování a limity
Dávky chlordioxidu používaného na zdravotní zabezpečení vody se pohybují mezi 0,15–0,30 mg/l. Limity pro obsah oxidu chloričitého a chloritanů v pitné vodě se liší stát od státu. V České republice jsou upraveny vyhláškou Ministerstva zdravotnictví č. 296/2006, která stanovuje maximální povolenou koncentraci chloritanů a oxidu chloričitého v pitné vodě 0,2 mg/l. Podobné limity mají stanovené i ostatní středoevropské státy. Ve Velké Británii je ale tato maximální koncentrace 0,8 mg/l a ve Spojených státech amerických dokonce 1 mg/l.
Technologické aspekty
Nejvýraznějším problémem, který je s dezinfekcí pomocí chlordioxidu spojen je to, že se tato látka redukuje na chloritany, které jsou ze zdravotního hlediska považovány za nebezpečné. Dávkované množství chlordioxidu se tedy pohybuje mezi 0,15–0,30 mg/l. Pro dávkování je tedy důležitá znalost reakční kinetiky oxidu chloričitého s různými látkami, které mohou být ve vodě obsažené. Problémem jsou například vody s vysokým obsahem dusitanů. Ty se totiž působením chlordioxidu oxidují velmi rychle a stačí poměrně malé množství (kolem 2 µmol/l dusitanů), aby byla dávka chlordioxidu během několika minut úplně spotřebována jen na oxidaci dusitanů. Problémem je také to, že při této reakci vznikají právě nežádoucí chloritany. Samotný chlordioxid může být také oxidován ozonem, v tomto případě vznikají toxické chlorečnany. To je z technologického hlediska též důležitý fakt, protože například nelze odstranit zbytku chlordioxidu pomocí ozonizace. Naproti tomu, ale chlordioxidnereaguje s bromem, a nedochází tak ke vzniku jedovatého bromoformu a bromičnanů jako při dezinfekci pomocí ozonu nebo chloru.
Závěr
Ač použití chlordioxidu k dezinfekce jak pitné, tak odpadní či užitkové vody přináší oproti jiných dezinfekčním činidlům (zejména chloru) řadu výhod, ani používání této látky není bez rizika. V případě chlordioxidu sice nevznikají karcinogenní trihalomethany, ale riziko mohou představovat chloritany a chlorečnany vzniklé reakcemi s některými typy sloučenin a látek obsažených ve vodě.Jeho vlastnosti, zejména schopnost hubit jinak rezistentní bakterie i v malých koncentracích, nezávislost účinku na pH a schopnost oxidovat železo a mangan, ho však předurčují nejen k zajištění sterility pitné vody, ale také k dezinfekci odpadních i průmyslových vod.

Úprava vody a problémy spojené s úpravou a filtrací vody. EuroClean se specializuje na projekce, výrobu a dodávky technologických celků řešících nestandardní problémy investorů s vodou a vodním hospodářstvím.