Odstraňování železa a manganu ze zdrojů pitné vody
Sloučeniny železa a manganu především v podzemních vodách bývají ve vysokých koncentracích. Sloučeniny železa a manganu nejsou pro zdraví člověka a živočichů škodlivé, jelikož se jedná o přírodní znečištění podzemní vody, způsobují však hygienické a zejména technologické závady.
Úvod
Vodními zdroji pro zásobování obyvatelstva, průmyslu a zemědělství jsou většinou podzemní a povrchové přírodní vody, přičemž pro toto zásobování je třeba zajišťovat množství vody s určitými vlastnostmi. Jakost vody je rozhodujícím faktorem pro způsob užívání vody a případné technologické úpravy vody. Odstraňování železa a manganu je jednou z úprav vody prováděných za účelem zásobování obyvatelstva, průmyslu a zemědělství. Ačkoliv sloučeniny železa a manganu se vyskytují ve vodách podzemních i povrchových, tak především v podzemních vodách, bývají jejich koncentrace v takových hodnotách, že je nutno přistoupit k jejich odstranění. Železo a mangan jsou ve vodě obsaženy většinou společně, a to v hodnotách od desetin mg.l−1 až po desítky mg.l−1. Sloučeniny železa a manganu nejsou pro zdraví člověka a živočichů škodlivé, jelikož se jedná o přírodní znečištění podzemní vody, způsobují však hygienické a zejména technologické závady. [1]
Zdroje a formy železa a manganu ve vodách
Nejrozšířenější železnou rudou je pyrit FeS2, pak následuje krevel Fe2O3, magnetovec Fe3O4, hnědel Fe2O3.H2O a siderit FeCO3. V malém množství se železo vyskytuje také v hlinitokřemičitanech. Pouhým vyluhováním uvedených látek se vody obohacují železem málo. Rozpouštění napomáhá přítomnost CO2, humusových kyselin a kyseliny sírové, která vzniká při oxidaci sulfidických rud. Antropogenním zdrojem železa v přírodních a užitkových vodách jsou průmyslové odpadní vody (např. z moříren, válcoven a drátoven) a korozní procesy ve vodovodním potrubí.
Ve vodách se železo vyskytuje v oxidačním stupni II nebo III, přičemž forma výskytu rozpuštěného a nerozpuštěného železa závisí na hodnotě pH, oxidačně-redukčním potenciálu a složení vody. Oxidační stupeň II se vyskytuje v redukčním prostředí podzemních vod a v povrchových vodách u dna nádrží a jezer. Ve vodách obsahujících rozpuštěný kyslík je železo nejčastěji v oxidačním stupni III. Mezi hlavní rozpuštěné formy železa ve vodách patří (v závislosti na hodnotě pH): Fe3+, Fe(OH)2+, Fe(OH)2+, Fe(OH)3(aq), Fe(OH)4−.
Mangan většinou v přírodě doprovází železné rudy. Z manganových rud se v přírodě vyskytuje zejména pyroluzit MnO2, braunit Mn2O3, hausmanit Mn3O4, manganit MnO(OH) a rodochrozit MnCO3. Do vody se mangan dostává z půd a sedimentů a také průmyslovou činností (zpracováním rud).
Ve vodě se mangan vyskytuje v rozpuštěné i nerozpuštěné formě, zejména v oxidačních stupních II, III a IV. V povrchových vodách se mangan může vyskytovat jako nerozpustný oxid manganičitý MnO2, v podzemních vodách je jeho nejstabilnější formou Mn2+, což je důsledkem redukčních podmínek bez přítomnosti vzdušného kyslíku a jiných oxidačních činidel. V kyselém a neutrálním prostředí se mangan vyskytuje zejména v rozpuštěné formě jako hydratovaný kationt [Mn(H2O)6]2+, dále se mohou vyskytovat komplexy [MnOH]+, [Mn(OH)3]−, [MnHCO3]+ a [MnSO4(aq)]° a při vyšších koncentracích chloridů i různé chlorokomplexy jako [MnCl]+, [MnCl2]° a [MnCl3]−. Výskyt iontů závisí na pH a složení vody. Pokud je ve vodě obsažen rozpuštěný kyslík, je mangan v oxidačním stupni II nestabilní a dochází k oxidaci. [2]
Hygienické limity železa a manganu ve vodách
Příloha č. 13 vyhlášky 120/2011 Sb. uvádí ukazatele jakosti surové povrchové i podzemní vody a jejich mezní hodnoty pro jednotlivé kategorie standardních metod úpravy surové vody na pitnou. Podle dosažených mezních hodnot jednotlivých ukazatelů je surová voda zařazena do kategorie upravitelnosti A1, A2 nebo A3 (v pořadí od úpravy nejjednodušší až po dvou či vícestupňovou). Zařazení do kategorií upravitelnosti A1 až A3 dle mezních hodnot železa a manganu v povrchové vodě uvádí tabulka 1.
| Ukazatel | Jednotka | A1 | A2 | A3 |
|---|---|---|---|---|
| mezní | mezní | mezní | ||
| Železo celkové | mg.l−1 | 0,2 | 1 | 2 |
| Mangan | mg.l−1 | 0,05 | 0,5 | 1,5 |
Zařazení do kategorií upravitelnosti A1 až A3 dle mezních hodnot železa a manganu v podzemní vodě uvádí tabulka 2.
| Ukazatel | Jednotka | A1 | A2 | A3 |
|---|---|---|---|---|
| mezní | mezní | mezní | ||
| Železo | mg.l−1 | 0,2 | 5 | 20 |
| Mangan | mg.l−1 | 0,05 | 1,0 | 2,0 |
Vyhláška č. 252/2004 Sb. stanoví hygienické požadavky na pitnou a teplou vodu a četnost a rozsah kontroly pitné vody. Dle této vyhlášky je mezní hodnota pro železo v pitné vodě 0,2 mg.l−1 a mezní hodnota pro mangan v pitné vodě 0,05 mg.l−1.
Způsoby odstraňování železa a manganu z vod
Jak již bylo zmíněno v úvodu, železo a mangan se vyskytují ve větší míře ve vodách podzemních, než povrchových. Zvýšené koncentrace železa a manganu ovlivňují především organoleptické vlastnosti vody, a to barvu, chuť a zákal. Větší množství těchto prvků ve vodě je pak příčinou rozvoje železitých a manganových bakterií, které mohou ucpávat vodovodní potrubí. Proto se v případě nadlimitních hodnot Fe a Mn v surové vodě přistupuje v technologickém procesu úpravy vody k jejich odstranění.
Podstatou odželezování a odmanganování je oxidace železnatých a manganatých sloučenin (Fe2+, Mn2+) na vyšší mocenství, v němž vytvářejí vločkovitou suspenzi, která se odstraňuje jednostupňovou nebo dvoustupňovou separací.
Nejrozšířenější metodou vylučování železa a manganu z vody je oxidace, a to především vzdušným kyslíkem, chlorem, manganistanem draselným a ozonem.
Odželezování a odmanganování vody oxidací
Oxidace vzdušným kyslíkem
Oxidace vzdušným kyslíkem je nejjednodušší metoda oxidace a je jí dosahováno mechanickým provzdušňováním. Při provzdušňování se okysličují hydrokarbonáty nebo sírany železa a manganu za současného uvolňování oxidu uhličitého (popř. sulfanu či metanu). Zároveň se při aeraci voda alkalizuje. [4]
Při aeraci dochází k těmto reakcím:
4 Fe(HCO3)2 + O2 + 2 H2O => 4 Fe(OH)3 + 8 CO2
2 Mn(HCO3)2 + O2 + 2 H2O => 2 MnO2 + 2 H2O + 4 CO2
V případě síranů probíhají reakce následovně:
4 FeSO4 + O2 + 10 H2O => 4 Fe(OH)3 + 4 H2SO4
MnSO4 + ½ O2 + H2O => MnO2 + H2SO4
Oxidace 1 mg Fe2+ vyžaduje 0,143 mg O2 a oxidace 1 mg Mn2+ vyžaduje 0,291 mg O2. Rychlost okysličování vody a hydrolýza oxidů železa a manganu probíhá v závislosti na pH vody po její aeraci. Při odželezování podzemních vod nemá pH klesat pod 7, při odmanganování se nedoporučuje pH nižší než 8,5. Jestliže hodnota pH po provzdušnění nedosáhne požadované výše, pak se doporučuje přidávat do provzdušněné vody alkalizační chemikálie, například hydroxid vápenatý, louh sodný a další. [5]
Provzdušňovací zařízení pro oxidaci vzdušným kyslíkem mohou být velmi jednoduchá, někdy postačuje kaskáda či vodní skok. V moderních úpravnách podzemních vod se provzdušňuje většinou zařízením INKA, využívají se i vertikální provzdušňovací věže nebo horizontální provzdušňovací zařízení, např. Bubla (viz obr. 1).
Oxidace chlorem
Oxidace chlorem vyžaduje kontrolu pH. Oxidace železa může probíhat již při pH menším než 7, oxidace manganu vyžaduje pH větší než 8, a to po delší dobu. Proto je vhodné oxidaci chlorem použít v prvním stupni oxidace pro odstranění železa. [4]
Odželezovací oxidační reakce pro hydrogenuhličitany probíhá podle rovnice:
2 Fe(HCO3)2 + Cl2 + Ca(HCO3)2 => 2 Fe(OH)3 + CaCl2 + 6 CO2
Odželezovací oxidační reakce pro sírany probíhá podle rovnice:
2 FeSO4 + Cl2 + 3 Ca(HCO3)2 => 2 Fe(OH)3 + 2 CaSO4 + CaCl2 + 6 CO2
Oxidace 1 mg Fe vyžaduje 0,647 mg Cl2. Reakce probíhá rychle a je účinná již při hodnotě pH nad 5. S vyšší hodnotou pH se zvyšuje i rychlost oxidace. V případě odmanganování se oxidace jenom chlorem používá vzácně. Chlor se používá pouze na oxidaci železa a manganaté sloučeniny jsou oxidovány následně např. manganistanem draselným. Časově je nutné obě reakce oddělit. Při dvoustupňové separaci se provede oxidace železa chlorem před prvním separačním stupněm a oxidace manganu manganistanem draselným před druhým separačním stupněm. [5]
Oxidace manganistanem draselným
Manganistan draselný působí jako silné oxidační činidlo, je silnějším oxidačním činidlem než chlor a je schopen zoxidovat jak železo, tak mangan. Při jeho redukci v neutrálním prostředí vzniká nerozpustný oxid manganitý či manganičitý. Konkrétně manganistanový anion (MnO4−) oxiduje manganaté kationty (Mn2+) za vzniku oxidu manganičitého MnO2 či oxidu manganitého Mn2O3, které jsou nerozpustné a mohou být lehce odfiltrovány. [7]
Při odmanganování vody manganistanem draselným probíhá proces podle následující rovnice:
3 Mn2+ + 2 MnO4− + 2 H2O => 5 MnO2 + 6 H+
Reakce probíhající při oxidaci železa manganistanem draselným je následující:
3 Fe2+ + MnO4− + 7 H2O => MnO2 + Fe(OH)3 + 5 H+
Tato reakce probíhá velmi rychle, a to i v neutrální oblasti pH. Teoretická spotřeba KMnO4 na 1 mg Fe2+ je 0,567 mg. Obsahuje-li voda organické látky, spotřebuje se část manganistanu také na jejich zoxidování. [8]
Oxidace ozonem
Odželezování ozonem se používá u vod, v nichž je železo vázáno v organických komplexech např. s huminovými látkami. Tyto látky působí jako ochranné koloidy a brání vylučování vloček Fe(OH)3. Chemická reakce je následující:
2 Fe3+ + O3 + 2 H+ → 2 Fe3+ + H2O + O2
Na oxidaci 1 mg Fe2+ je teoreticky zapotřebí 0,43 mg O3. Rychlost oxidace je závislá na době kontaktu odželezované vody s ozonem.
Oxidace Mn2+ ozonem probíhá velmi rychle podle následující reakce:
Mn2+ + O3 + H2O → MnO2 + O2 + 2 H+
Dávkování ozonu musí být takové, aby došlo k oxidaci Mn2+ jen na MnO2. Pokud je ozonu více, vzniká MnO4− a voda se barví do fialova. [8]
Odželezování a odmanganování vody biologickým způsobem
Metabolismus některých bakterií je založen na oxidaci Fe2+ na Fe3+, která za příznivých podmínek probíhá velmi rychle. Ke známým rodům bakterií patří rod Leptothrix, Crenothrix, Siderocapsa, Ferrobacillus, Galionella a další. Způsob předpokládá, že surová voda obsahuje amoniak. [8] Odstranění železa biologickým způsobem probíhá i za podmínek, při nichž chemická oxidace neprobíhá, tedy při koncentraci kyslíku 0,2 až 0,5 g.m−3, pH 6,3 a oxidačně-redukčním potenciálu 250 mV. [9]
Mangan lze biologicky oxidovat pomocí různých bakterií, z nichž některé způsobují oxidaci Mn nepřímo v důsledku zvýšení pH spojeného s jejich rozmnožováním. Jiné bakterie oxidují mangan pomocí svých intracelulárních enzymů nebo adsorbují mangan rozpuštěný na povrchu buněčné membrány a pak dochází k jeho oxidaci pomocí extracelulárních enzymů. Mangan se poté koncentruje do vrstvy, která obklopuje buňku nebo skupinu buněk. Rozvoj bakterií vyžaduje prostředí s hodnotou oxidačně-redukčního potenciálu nad 400 mV. [8]
Při současném odželezování a odmanganování biologickým způsobem se doporučuje dvoustupňový filtrační proces, neboť oxidačně-redukční potenciály pro biologickou oxidaci obou prvků jsou značně rozdílné. V prvním stupni (na tlakových filtrech) se odstraní železo a ve druhém stupni (na otevřených filtrech) mangan. [9]
Další způsoby odželezování a odmanganování vody
K odželezování a odmanganování vody lze použít i vápnění, tedy dávkování hydroxidu vápenatého. Ekonomicky výhodnější je však kombinovat vápnění s aerací.
Odstranění železa i manganu lze docílit též měniči iontů v sodíkovém nebo vápníkovém cyklu . Výměna probíhá podle rovnic (měnič v rovnici označen M):
Fe2+ + 2 MNa → M2Fe + 2 Na+
Fe2+ + M2Ca → M2Fe + Ca2+
Regenerace těchto katexů se provádí buď 2% roztokem chloridu sodného nebo 5% roztokem chloridu vápenatého.
Rovněž koagulaci lze využít pro odželezování a odmanganování vod. Používají se jak klasické anorganické koagulanty (soli Al a Fe), tak polymerní flokulanty. Jejich dávka se stanovuje z výsledků laboratorních koagulačních zkoušek.
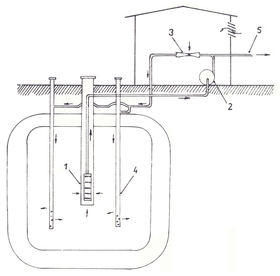
Obr. 2 Schéma okruhu Vyredox [10]
1 – jímací studna, 2 – čerpadlo, 3 – ejektor, 4 – vsakovací studna, 5 – odtok upravené vody
Již od konce 19. století je známa technologie odželezování a odmanganování podzemní vody v horninovém prostředí. K většímu uplatnění této technologie však došlo až počátkem 60. let minulého století ve Skandinávii. Způsob známý pod názvem Vyredox využívá cirkulace vody obohacené vzduchem mezi soustavou vsakovacích a jímacích studní (obr. 2).
Provzdušněná voda proniká do horniny. V mezerách mezi zrny dochází k růstu železitých bakterií, a tedy k snižování koncentrace rozpuštěného železa. Takto upravená voda se jímá studnami a dopravuje do spotřebiště. [10]
K odstranění především manganu z vody lze rovněž využít filtraci na manganičitých filtrech, tedy kontaktní filtraci. Mangan je separovatelný při kontaktní oxidaci na zrnitém materiálu za přítomnosti katalyzátoru. Při oxidaci dochází k tvorbě povlaku na povrchu filtrační náplně, který slouží jako katalyzátor oxidační reakce. Na různých filtračních náplních dochází k tvorbě povlaků s různými schopnostmi odstraňovat rozpuštěný mangan z vody. Při tomto způsobu odstraňování se používají buď přirozené, nebo uměle preparované filtrační materiály. Z přirozených materiálů je nejrozšířenější pyroluzit MnO2 (manganová pěna), který má velký aktivní povrch. Z umělých materiálů jsou používány kaolínové a plavené písky, preparované ve vlastních filtrech. Kromě klasického preparovaného filtračního písku se v současnosti využívají různé materiály s vytvořenou oxidační vrstvičkou na povrchu zrn filtrační náplně, jako např. Klinopur Mn, Greensand, Birm, Culsorb M, Everzit Mn a MTM. [11]
Závěr
V technologickém procesu úpravy vody se zvýšeným obsahem železa a manganu závisí počet separačních stupňů na součtu množství železa a manganu v surové vodě. Pokud je součet koncentrací těchto prvků menší než 5 mg.l−1, pak stačí úprava vody v jednom separačním stupni. V případě vyšších koncentrací železa a manganu v surové vodě se volí úprava dvoustupňová, případně i třístupňová (např. sedimentace, odželezovací filtry, odmanganovací filtry).
Poděkování
Příspěvek byl zpracován v rámci řešení grantového projektu specifického výzkumu VUT v Brně s názvem „Odstraňování specifických látek ze zdrojů pitné vody“ (FAST-S-12-36/1713).
Použitá literatura
- [1] ŽÁČEK, Ladislav. Chemické a technologické procesy úpravy vody. Brno: NOEL, 2000. 239 s. ISBN 80-86020-22-2.
- [2] PITTER, Pavel. Hydrochemie. 2. vyd. Praha: SNTL, 1990. 565 s. ISBN 80-03-00525-6.
- [3] ČR. Vyhláška 120/2011 Sb. In: Sbírka zákonů. Praha: Tiskárna Ministerstva vnitra, p.o., 6. května 2011, roč. 2011, č. 120, částka 46.
- [4] STRNADOVÁ, Nina, JANDA, Václav. Technologie vody I. 2. přeprac. vydání. Praha: Vydavatelství VŠCHT, 1999. 226 s. ISBN 80-7080-348-7.
- [5] TUHOVČÁK, Ladislav, et al. Vodárenství: Studijní opory. 1. vydání. Brno: VUT FAST, 2006. 252 s.
- [6] Vodárenské technologie, s.r.o. [online]. 2011 [cit. 2012-09-07]. Dostupné z WWW: http://www.vodatech.cz/.
- [7] LÍZALOVÁ, Zuzana. Odstraňování železa a manganu z podzemních zdrojů vody. Brno, 2012. 63 s. Bakalářská práce. VUT v Brně, Fakulta stavební, Ústav vodního hospodářství obcí.
- [8] GRÜNWALD, Alexander. Zdravotně inženýrské stavby 40: Úprava vody. 1. vydání. Praha: Vydavatelství ČVUT, 2002. 103 s. ISBN 80-01-0165-7.
- [9] MALÝ, Josef; MALÁ, Jitka. Chemie a technologie vody. 2. doplněné vydání. Brno: Ardec s.r.o., 2006. 329 s. ISBN 80-86020-50-9.
- [10] BIELA, Renata; BERÁNEK, Josef. Úprava vody a balneotechnika. Brno: Akademické nakladatelství CERM, s.r.o., 2004. 164 s. ISBN 80-214-2563-6.
- [11] BARLOKOVÁ, Danka; ILAVSKÝ, Ján. Odstraňovanie železa a mangánu z malých vodných zdrojov. Praha: SOVAK Časopis oboru vodovodů a kanalizací, 2009, č. 4, s. 14.
The article describes the sources and forms of iron and manganese in water, their health limits and possibilities removal of iron and manganese from the water. The most widely used method of removing these elements from water is oxidation, but are described also other options.
